T
Teach Me AnythingTMA
Video History
Page 4 / 44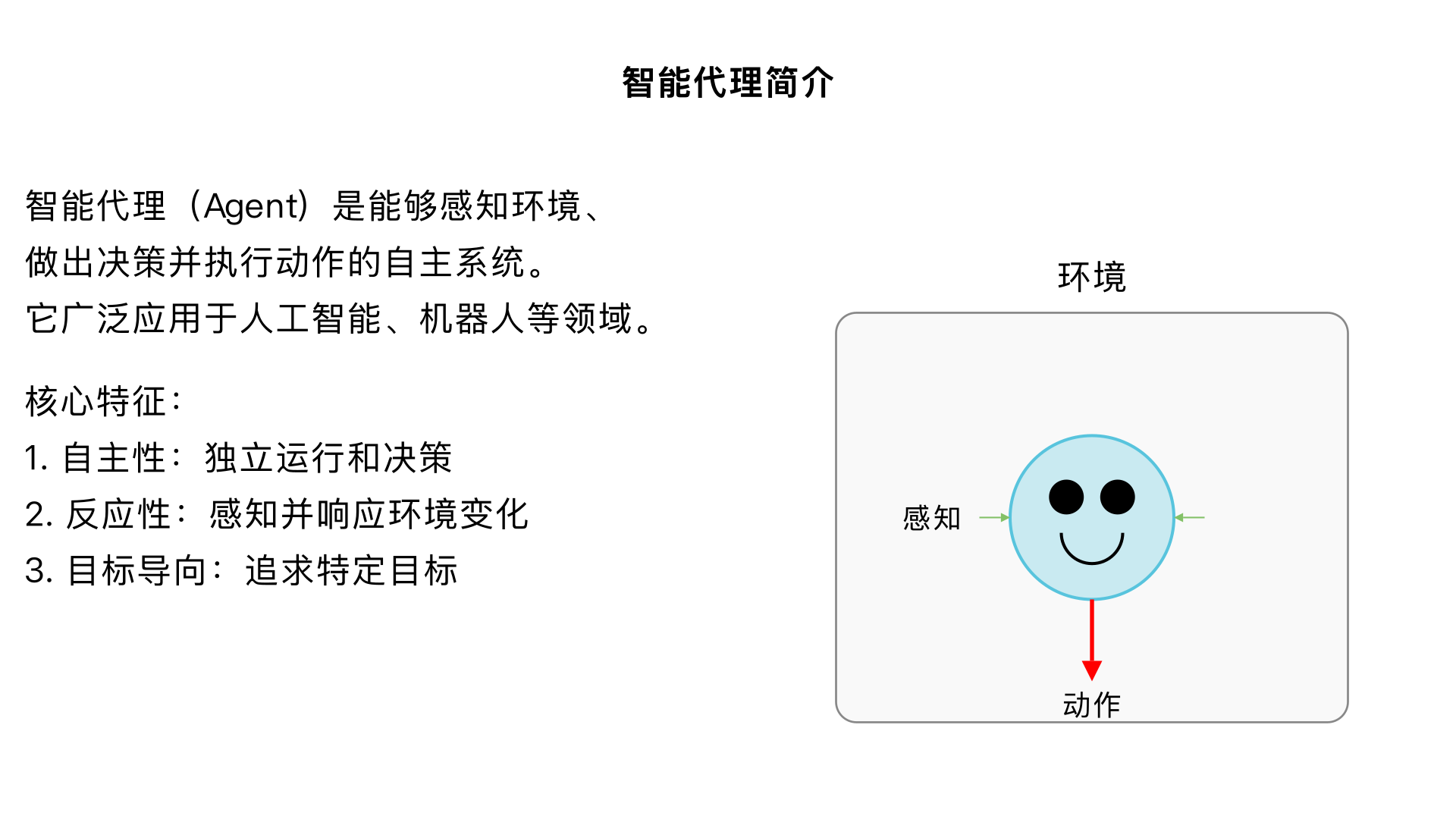
▶
introduce agent
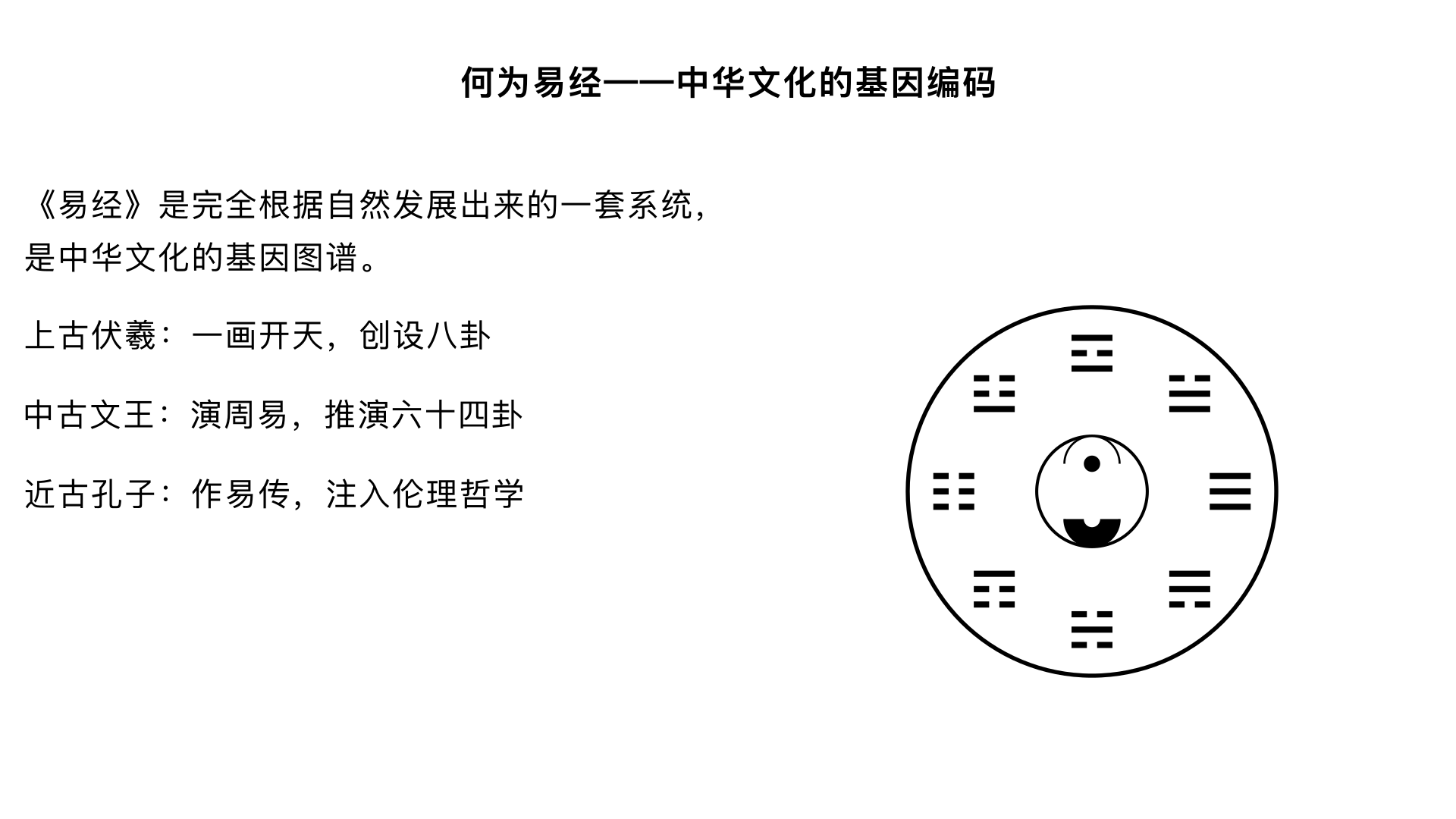
▶
主题一:何为易经——中华文化的基因编码 文化定位的再审视:曾仕强在本集开篇即破除迷信解读,指出《易经》是“完全根据自然发展出来的一套系统”。他通过对比中西思维差异,强调《易经》不重“实证”重“感应”,是中国人特有的象思维源头。 三古三圣的传承脉络: 上古伏羲:一画开天,创设八卦,“仰观天文,俯察地理,近取诸身,远取诸物”,开创了符号表征自然的先河。 中古文王:被囚羑里而演《周易》,将八卦两两相重,推演六十四卦,并作卦爻辞,使《易》系统化、人文化。 近古孔子:作《易传》(十翼),为《易经》注入深刻的伦理哲学,将其从占筮之书提升为“修身齐家治国平天下”的义理之学。 核心论点:曾仕强提出《易经》是中华文化的“基因图谱”,儒家主张的“仁义”、道家崇尚的“无为”,乃至中国人的家庭伦理、中庸之道,其思维方式皆可在此找到源头。

▶
解释一下大模型的自回归原理
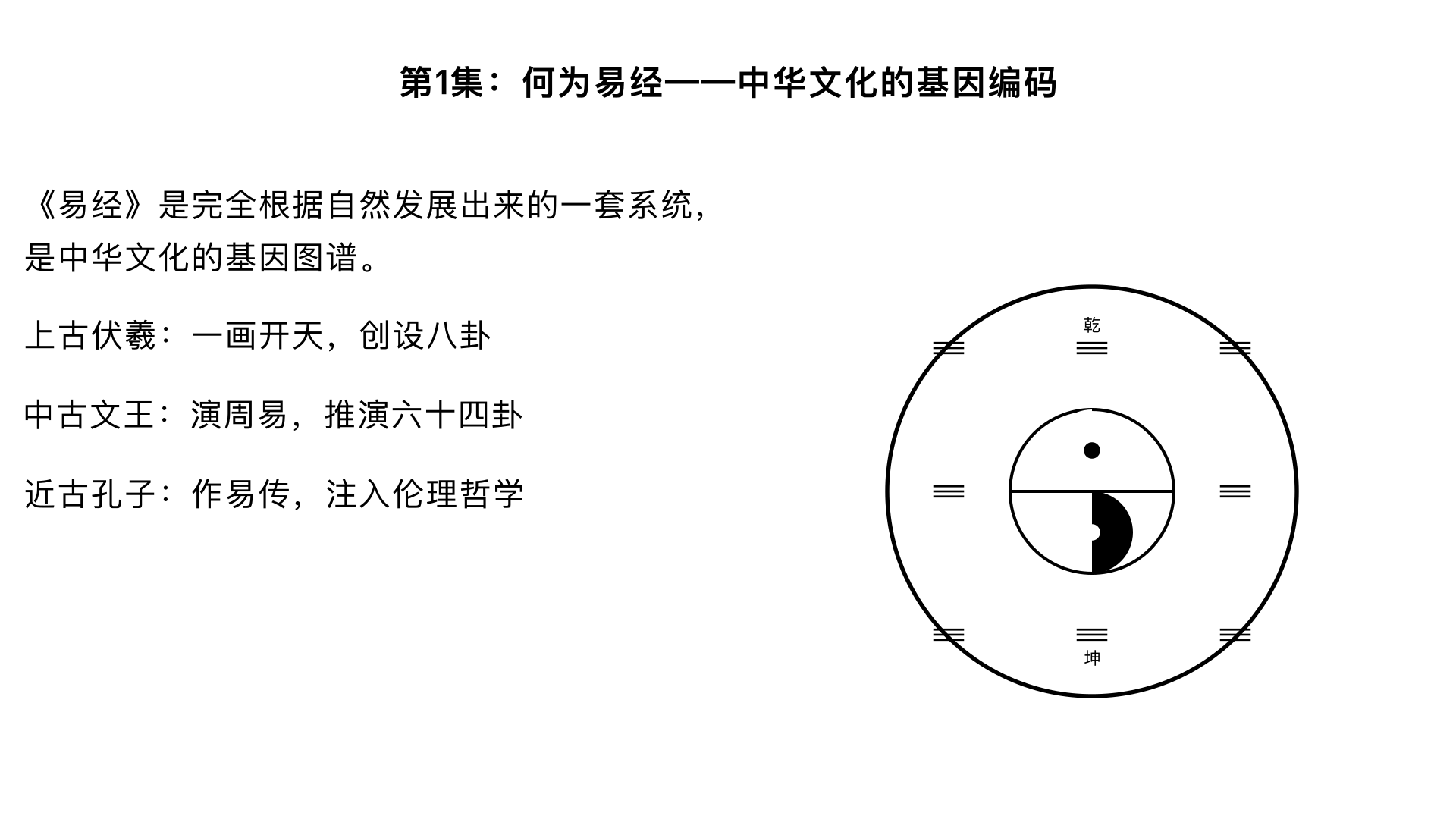
▶
第1集:何为易经——中华文化的基因编码 文化定位的再审视:曾仕强在本集开篇即破除迷信解读,指出《易经》是“完全根据自然发展出来的一套系统”。他通过对比中西思维差异,强调《易经》不重“实证”重“感应”,是中国人特有的象思维源头。 三古三圣的传承脉络: 上古伏羲:一画开天,创设八卦,“仰观天文,俯察地理,近取诸身,远取诸物”,开创了符号表征自然的先河。 中古文王:被囚羑里而演《周易》,将八卦两两相重,推演六十四卦,并作卦爻辞,使《易》系统化、人文化。 近古孔子:作《易传》(十翼),为《易经》注入深刻的伦理哲学,将其从占筮之书提升为“修身齐家治国平天下”的义理之学。 核心论点:曾仕强提出《易经》是中华文化的“基因图谱”,儒家主张的“仁义”、道家崇尚的“无为”,乃至中国人的家庭伦理、中庸之道,其思维方式皆可在此找到源头。
▶
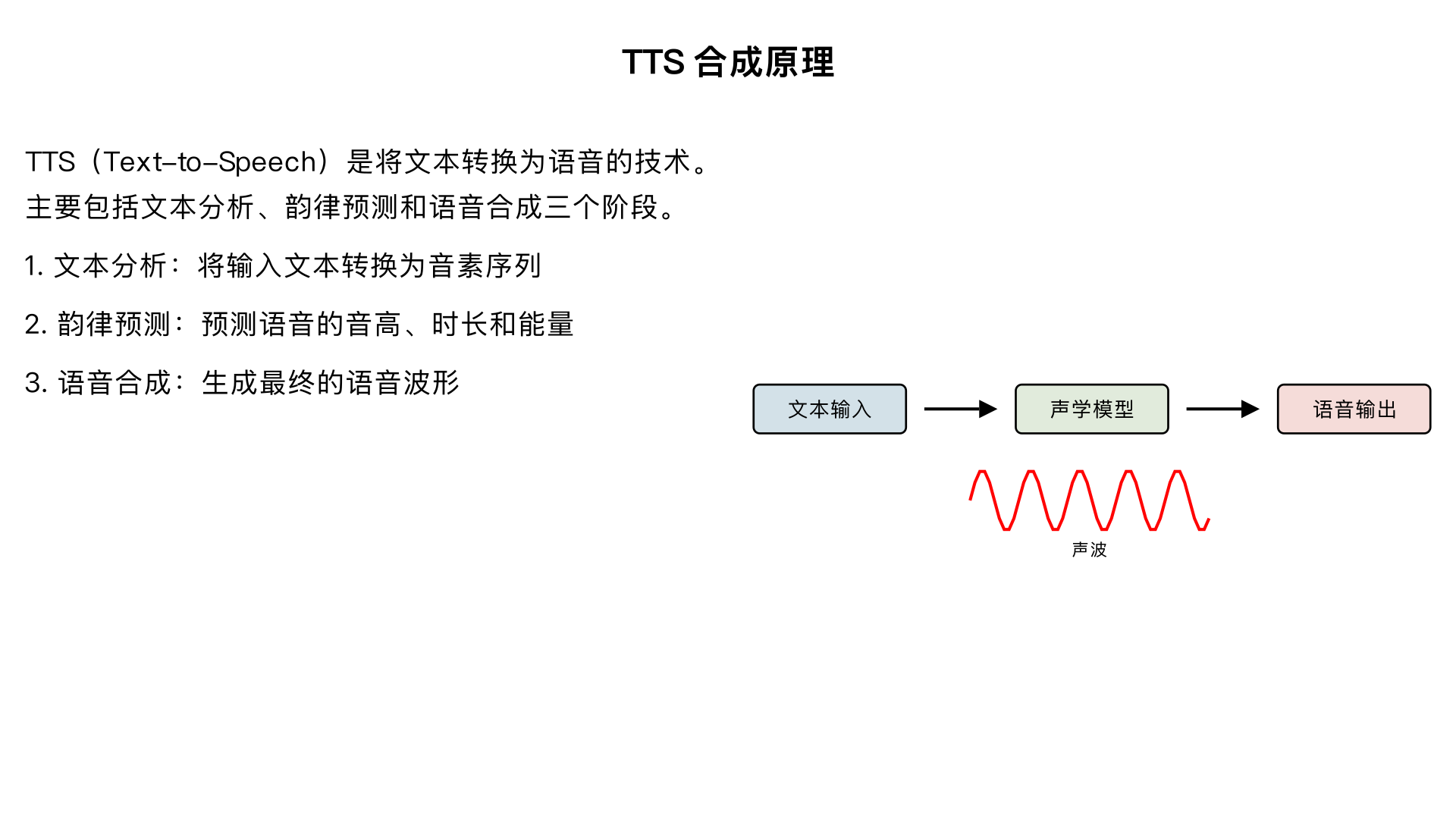
TTS 合成原理
▶
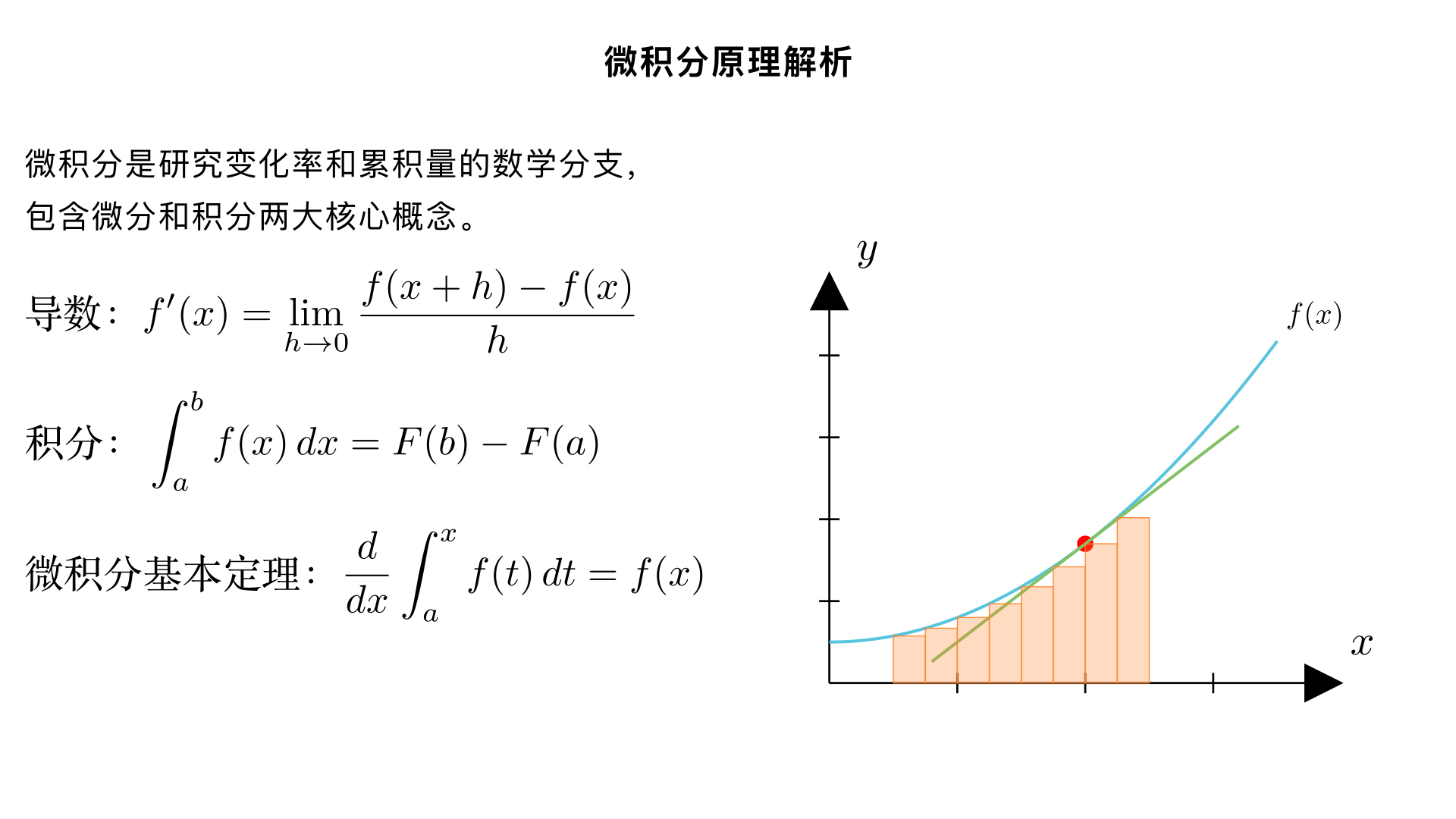
帮我解析一下微积分原理
▶
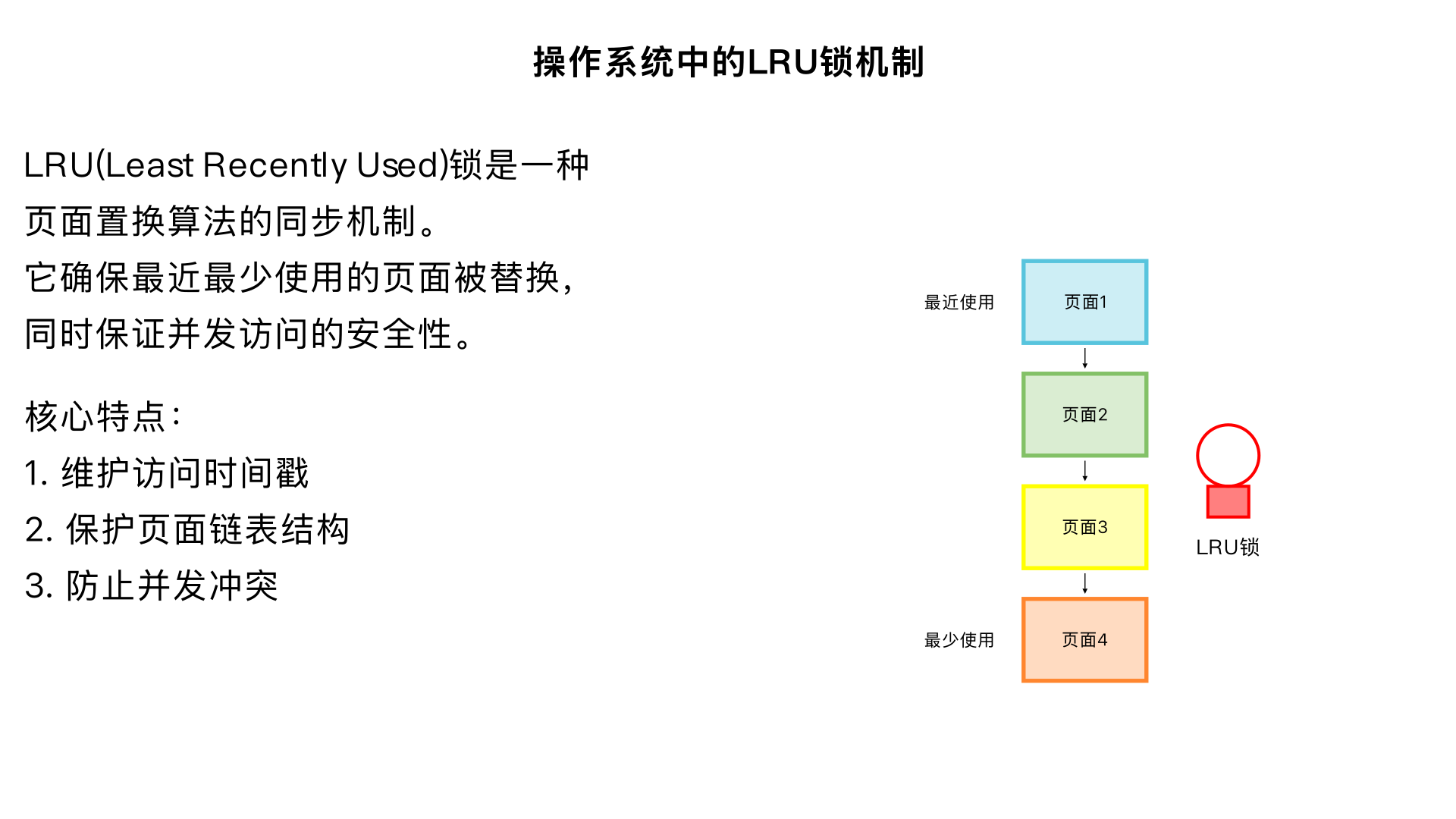
给我简述一下操作系统中的LRU锁的机制
▶
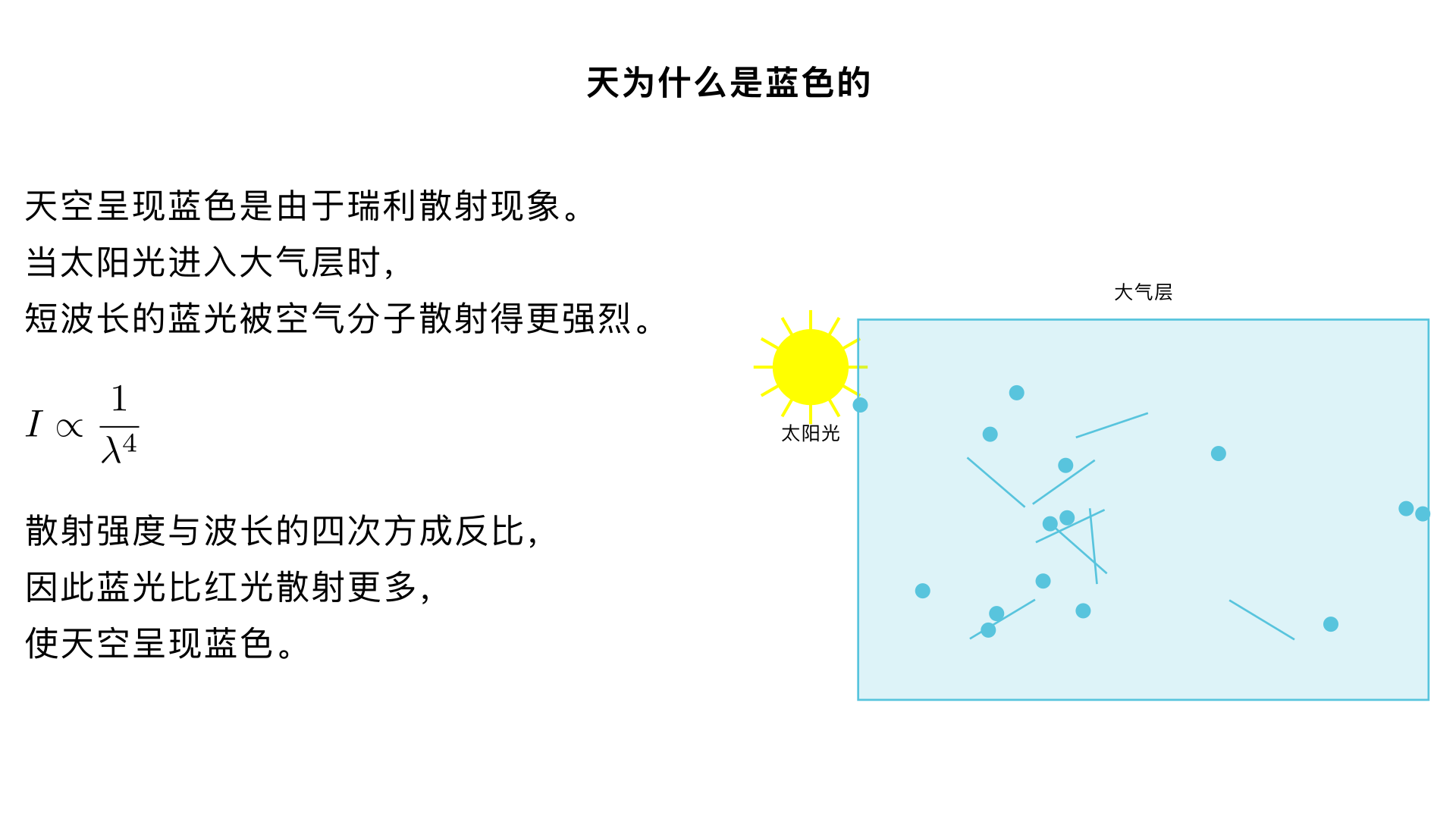
天为什么是蓝色的
▶
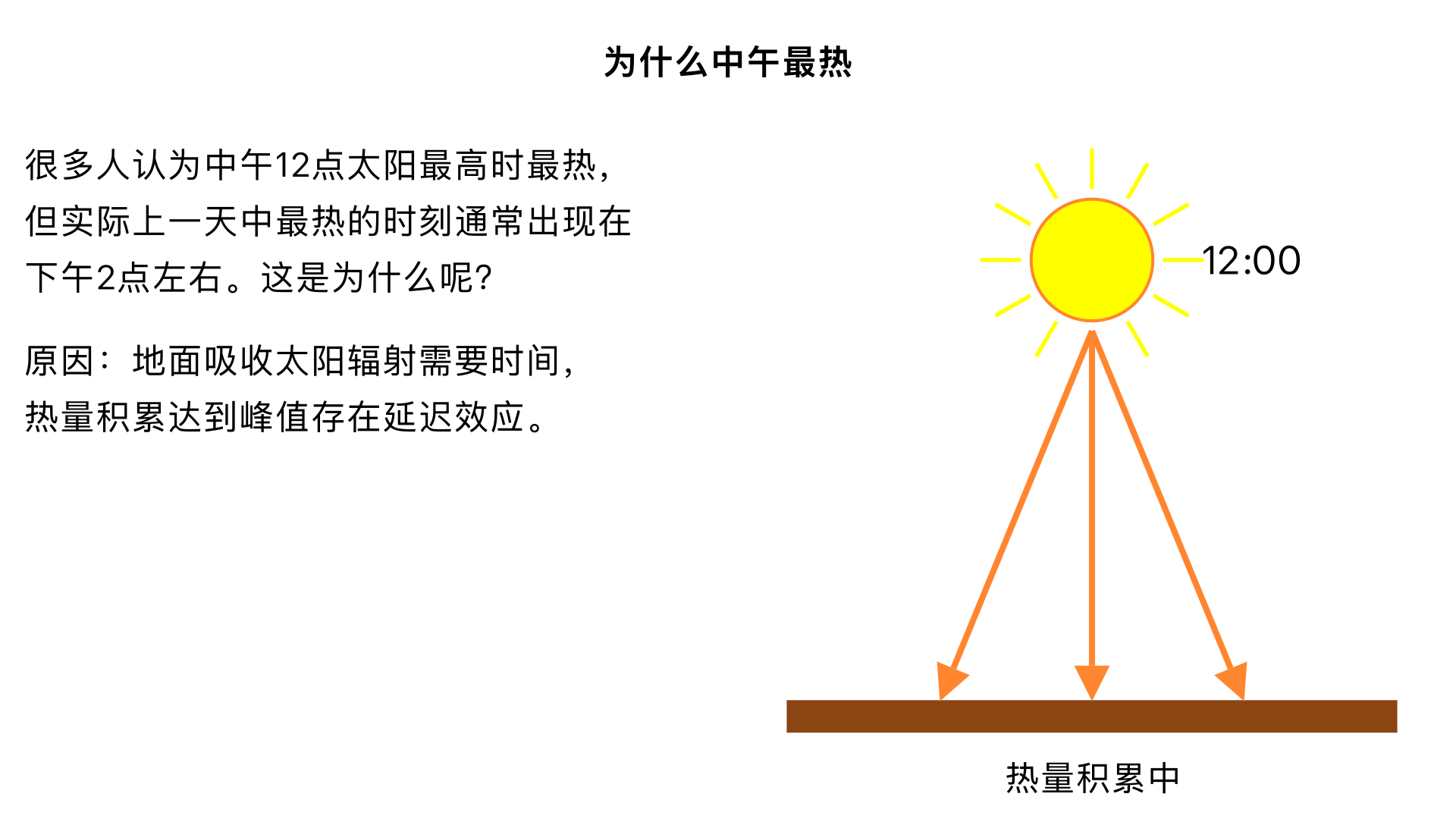
为什么中午最热
▶
1 何为易经 核心内容:纠正《易经》是“算命书”的误解,阐述其作为中国哲学思想总源头、“群经之始”的文化定位。 关键要点: • 《易经》是完全根据自然发展出来的系统,是中华文化的总源头、诸子百家的开始。 • 解读《易经》的三个关键:伏羲八卦、文王六十四卦、孔子《十翼》。 • 学习《易经》的现代意义:帮助我们理解自然规律,指导生活决策。
▶
从《周易全解》出发——易学研究的未来路径 完成对《周易全解》的学习,是易学研究的扎实起点而非终点。本节课将为你梳理学术脉络,指明未来深入探索的可能方向。 一、金景芳易学思想的贡献与特色 义理派传统的坚实继承与发扬:金景芳先生是现当代义理易学的旗帜。他彻底接续并光大了从王弼到程颐的义理传统,彻底扫除汉代象数易学中谶纬、神秘的成分,始终坚持以《易传》(特别是《彖传》《象传》)解经,专注于阐发卦爻辞中的哲学、伦理和政治思想。 严谨的历史与文献功底:他的解读绝非空谈玄理,而是建立在扎实的经学与史学基础之上,常引《尚书》《诗经》《左传》等经典及历史事例互证,使深邃的易理有坚实的史实依托。 体系化的哲学建构:如前课所述,他将《周易》零散的智慧系统地构建为宇宙论、方法论、人生观的完整体系,使现代读者能清晰地把握《周易》的思想全貌。 二、义理派与象数派的异同与价值 理解两派的分别,是把握易学流变的关键。《四库全书总目》曾将易学分为“两派六宗”,可简括如下: 派别 核心宗旨 主要分支(宗) 代表人物/时代 价值与局限 象数派 通过卦爻的象征、数字关系及复杂推演(如互体、卦气、纳甲),来探究天道规律、推测人事吉凶。 占卜、禨祥(祥瑞灾异)、造化(宇宙生成) 孟喜、京房(汉);邵雍(宋) 保留了古人的宇宙认知模式和原始科学思维,是易学的源头和重要组成部分。但后世易流于繁复、牵强,甚至陷入神秘主义。 义理派 抛开繁琐的象数推演,直接阐发《周易》卦爻辞中蕴含的哲学道理、人伦义理和政治思想。 老庄(玄学)、儒理、史事 王弼(魏晋);程颐、胡瑗(宋);金景芳(现代) 将《周易》从占卜之书提升为哲学经典,奠定了其在中国思想史上的核心地位。但若完全脱离象数,有时可能陷入主观阐释。 核心区别:象数派认为“《易》之义本起于数”,义理派则认为“有理而后有象,有象而后有数”。两者并非绝对对立,只是侧重点不同。金景芳先生的路径属于典型的“义理优位”。 三、后续研究方向推荐 溯源与深化:精读义理派经典注本 王弼《周易注》:义理派的开山之作。王弼“尽黜象数”,以老庄玄学解《易》,提出“得意忘象”的方法论。读王弼是理解易学如何从汉学转向玄学的关键。可选用楼宇烈校释的《王弼集校释》。 程颐《程氏易传》:宋代理学易的奠基之作。程颐虽借鉴王弼,但“扬弃其老庄思想”,纯以儒家理学(天理)解《易》,提出“体用一源,显微无间”的命题,对后世影响极大。 王夫之(船山)易学:明末清初的集大成者。他“融合象数与义理”,批判佛道空无,建立“气本论”哲学,其“乾坤并建”、“生生不息”的思想极具深度。阅读船山易学有助于形成辩证、宏大的历史哲学视野。 开拓与新证:结合出土文献 帛书《周易》研究:20世纪70年代长沙马王堆汉墓出土的帛书《周易》,是不同于通行本的最古老抄本之一。研究其卦序、文字异同,可以窥见汉代早期易学的面貌,为解决许多易学悬案提供新线索。这是现代易学研究的前沿领域。 拓展与贯通:通览易学哲学史 建议阅读朱伯崑先生的四卷本《易学哲学史》。这部巨著系统梳理了从先秦到清代易学的发展脉络,尤其详细分析了各时期象数与义理两派的哲学思想,能帮助你将所学置于两千年的学术长河中进行定位,构建完整的知识图谱。 希望这最后两课能帮助你完成从“学一本经典”到“识一门学问”的跨越。正如《周易》本身所启示的,学问之道,既要有潜心钻研的“艮止”,也要有博观约取的“晋进”。祝你未来的探索之旅充实而愉快!

▶